Sommaire général
1. Composition des eaux usées domestiques
1. Composition des eaux usées domestiques
1.1. Paramètres globaux de définition de la pollution des eaux résiduaires urbaines
1.1.1. Pollution particulaire
1.1.2. Pollution oxydable
1.1.3. Pollution azotée
1.1.4. Pollution phosphorée
1.1.5. Autres paramètres de pollution
1.2. Quantification de la pollution amenée par les eaux résiduaires urbaines
1.2.1. Ancienne définition (antérieure au 1er janvier 2005)
1.2.2. Nouvelle définition (à partir du 1er janvier 2005 et pour une durée de 2 ans)
1.1. Paramètres globaux de définition de la pollution des eaux résiduaires urbaines
1.1.1. Pollution particulaire
Un seul paramètre permet de quantifier cette pollution : les matières en suspension (MES) : masse de l'ensemble des particules minérales et organiques véhiculées par les eaux. Unité : mg ou g/L
1.1.2. Pollution oxydable
- Demande Chimique en Oxygène (DCO) : consommation d'oxygène dans les conditions d'une réaction d'oxydation, en milieu sulfurique, à chaud et en présence de catalyseur, par les matières oxydables de l'eau. Ces matières oxydables sont dissoutes ou particulaires et de nature minérale ou organique. Unité : mg d'O2/L
- Demande Biochimique en Oxygène sous 5 jours (DBO5) : consommation d'oxygène en 5 jours à 20°C, à l'obscurité, résultant de la métabolisation de la pollution biodégradable par les microorganismes de contamination banale des eaux. Ces matières sont de nature dissoute ou particulaires. Elle représente la fraction biodégradable de la DCO. Unité : mg d'O2/L
- Matières oxydables : désigne les matières organiques (ensemble des substances d'origine biologique) et autres substances oxydables contenues dans un effluent ou un biotope aquatique pollué. Ce paramètre se détermine de la façon suivante : (DCO + 2 DBO5)/3. Unité : mg /L
1.1.3. Pollution azotée
Azote réduit
- Azote ammoniacal : forme NH4+. Unités : mg NH4+/L ou mg N- NH4+/L
- Azote de Kjeldahl (NK) : quantité d'azote exprimée en N correspondant à l'azote organique (R-NH2) et à l'azote ammoniacal. Unité : mg N-NK/L
Azote oxydé
- Azote nitrique : forme nitrate NO3-, Unités : mg NO3- /L ou mg N- NO3- /L
- Azote nitreux : forme nitrites : NO2-, Unités : mg NO2- /L ou mgN- NO2-/L
1.1.4. Pollution phosphorée
- Orthophosphates : formes PO43-, HPO42- et H2PO4-. Ces différentes formes se répartissent en fonction du pH. Au pH moyen des eaux usées on ne trouve donc que les formes HPO42- et H2PO4-.
- Phosphore total (PT) : somme du phosphore contenu dans les orthophosphates, les polyphosphates et le phosphore organique. Unité : mg P/L
1.1.5. Autres paramètres de pollution
- Equitox : quantité de toxicité, qui dans 1m3 d'eau, immobilise, au bout de 24 heures, 50% des daphnies présentes (micro-crustacés des aux douces).
- Métox : paramètre établis par les agences de l'eau, afin de percevoir les redevances de pollution. Le métox est calculé par la somme pondérée (en mg/L) de huit métaux et métalloïdes, affectés de coefficients de pondération liés aux différences de toxicité des éléments : mercure 50, arsenic 10, plomb 10, cadmium 10, nickel 5, cuivre 5, chrome 1 et zinc 1.
1.2. Quantification de la pollution amenée par les eaux résiduaires urbaines
La pollution générée par l'homme est quantifiée par la notion d'Équivalent Habitant (EH) qui correspond à la quantité de pollution rejetée ou au volume d'eau rejetée par jour et par habitant. Cette quantification s'exprime en concentration massique (mg/L) ou en flux (g/j/habitant).
1.2.1. Ancienne définition (antérieure au 1er janvier 2005)
| Paramètre | Concentration moyenne en mg/L | Flux moyen en g/j/hab | Fraction décantable en % |
| D'après : Étude interagences n°27- l'assainissement des agglomérations | |||
| MES | 100 à 400 | 60 à 70 | 50 à 60 |
| DCO | 300 à 1000 | 120 à 140 | 30 |
| DBO5 | 150 à 500 | 70 | 25 à 30 |
| N-NK | 30 à 100 | 13 à 15 dont 1/3 ammonium et 2/3 organique | 30 |
| PT | 10 à 25 | 4 dont 80 % d'orthophosphate et 20 % de P organique | 10 |
| Volume d'eaux usées | 150 à 400 L/j/hab |
1.2.2. Nouvelle définition (à partir du 1er janvier 2005 et pour une durée de 2 ans)
| D'après : arrêté du 9 décembre 2004 | ||
| Paramètre | Flux moyen en g/j/hab | Fraction décantable en % |
| MES | 90 | 50 à 60 |
| Matière oxydables | 57 | 30 |
| Équitox de matières inhibitrices | 0,2 | 25 à 30 |
| Azote réduit (N-NK) | 15 dont 1/3 ammonium et 2/3 organique | 30 |
| Phosphore total (PT) | 4 dont 80 % d'orthophosphate et 20 % de P organique | 10 |
| Composés organohalogénés absorbables sur charbon actif | 0,05 | |
| Métox | 0,23 |
Retour au sommaire
2. Élimination du carbone
2.1.2. Caractéristiques des matières polluantes à éliminer
2.1.2.1. Matières solides et colloïdes
2.1.3.1. Structure de la boue activée
2.1.3.2. Composition de la boue activée
2.1.3.3. Fonctionnement de la boue activée
2.1.3.4. Processus biochimiques
2.2. Par voie physico-chimique
2.2.2. Caractéristiques des matières polluantes à éliminer
2.2.3. Phase chimique : la coagulation
2.2.3.1. Élimination des colloïdes
2.2.3.2. Élimination du phosphore
2.2.4. Phase physique : la floculation et la décantation
2.2.4.1. Maturation du solide : la floculation
2.2.4.3. Procédé de décantation
2.2.5.1. Détermination de la dose optimale de réactif
2.2.5.2. Filière de traitement
2.3. Paramètres de conduite des stations à boues activées
2.1. Par voie biologique
2.1.1. Objectifs et principe
2.1.1.1. Objectifs
Il s'agit essentiellement de réaliser l'élimination de composés organiques biodégradables et de l'azote ammoniacal. Certains procédés permettent l'élimination de l'azote nitrique et même du phosphore.
Le traitement par voie biologique de la pollution organique dissoute constitue le premier mode de traitement secondaire le plus couramment utilisé en raison de son efficacité.
2.1.1.2. Principe
Le traitement s'effectue dans un réacteur ou l'on met en contact des microorganismes épurateurs et l'eau à épurer. On distingue alors plusieurs procédés possibles :
- Culture fixée ou culture libre
- Processus aérobie ou anaérobie
On ne s'intéressera ici qu'au cas du procédé à culture libre aérobie.
Les microorganismes épurateurs sont en suspension dans un bassin aéré, on parle alors de procédé à boues activées. Le réacteur est alimenté en continu (eau usée) et la biomasse transforme les polluants :
- par adsorption ou absorption des matières polluantes sur le floc bactérien,
- par conversion de la DBO5 en matière cellulaire : croissance de la culture bactérienne et des microorganismes associés : insolubilisation de la pollution,
- par oxydation en CO2 et H2O qui produit l'énergie nécessaire au fonctionnement et la production de nouveau matériau cellulaire : transformation de la pollution dissoute en gaz.
Environ un tiers de la matière organique de l'eau usée doit être oxydée pour produire l'énergie requise. En conséquence, deux tiers subsistent sous forme de boues en excès (biomasse épuratrice générée).
Si la séparation des phases d'eau épurée et de la boue en excès est convenablement réalisée, c'est plus de 80 à 95 % de la charge organique introduite qui peut être soustraite de l'eau à traiter en un temps très court.
On aura donc deux phases :
- Phase biologique : transformation de la pollution dissoute en gaz ou en biomasse
- Phase physique : séparation de la biomasse épuratrice de l'eau épurée : décantation
2.1.2. Caractéristiques des matières polluantes à éliminer
2.1.2.1. Matières solides et colloïdes
La biomasse épuratrice n'aura que très peu d'impact sur l'élimination des MES et des colloïdes. Ils seront éliminés lors de la phase de décantation, les colloïdes s'adsorbant sur le floc bactérien.
2.1.2.2. Matières dissoutes
Elles comprennent le Carbone Organique Dissous Biodégradable (CODB) et le Carbone Organique Dissous Réfractaire (CODR).
La biomasse épuratrice utilise le CODB comme source de carbone et d'énergie et n'a aucune action sur le CODR. En conséquence le CODR représente la fraction non biodégradable de la matière organique et quantifiée dans la DCO soluble, quant au CODB, il représente la fraction biodégradable quantifiée dans la DBO5.
2.1.3. Phase biologique
Les polluants sont éliminés par oxydations biologiques, pour la plupart, grâce à une microfaune aérée constituée de bactéries chimioorganotrophes principalement, de protozoaires voire de métazoaires : les boues activées. La forte concentration en microorganismes (2 à 5 g/L) est maintenue constante grâce à un recyclage de la biomasse qui permet de maintenir, dans le bassin à boue activée, un taux de croissance constant. Le système d'apport de l'air permet le brassage de la biomasse et évite sa décantation dans le bassin d'aération.
La filière biologique est envisageable dès lors que :
- le rapport DCO/DBO5 est inférieur à 3, ce qui correspond à un bon indice de biodégradabilité de l'effluent.
- le rapport carbone/azote/phosphore de l'effluent est de 100/5/1 ce qui correspond à un bon équilibre en nutriments, permettant ainsi le développement optimal de la biomasse épuratrice.
2.1.3.1. Structure de la boue activée
La boue activée est constituée par le floc, lui-même étant constitué de bactéries agglomérées, emprisonnées dans une matrice organique. Dans les conditions d'une eau usée, les bactéries sont sous-alimentées et pour mieux résister vont sécréter des polymères exocellulaires composés d'un mélange de polyosides principalement. Grâce à ce polymère, les bactéries peuvent :
- adhérer les unes aux autres pour éviter une dispersion des bactéries
- retenir et adsorber les substances nutritives de l'eau usée, et donc de concentrer les matières nutritives (DBO5, O2…) au voisinage des bactéries.
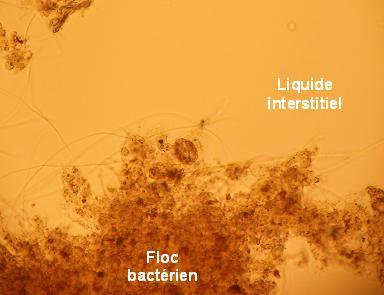
Viennent ensuite se développer sur et à proximité de ces flocs une faune de protozoaires voire de métazoaires qui profitent de cet « oasis ».
2.1.3.2. Composition de la boue activée
- Bactéries à raison de 6,6 milliards/mL de boue activée. Elles représentent la biomasse la plus abondante par le nombre. On y trouve des germes de l'environnement et pour l'essentiel des bacilles Gram-, aérobies et mobiles. Les principaux genres sont Pseudomonas, Aeromonas, Arthrobacter, Flavobacter, Achromobater et Alcaligenes.
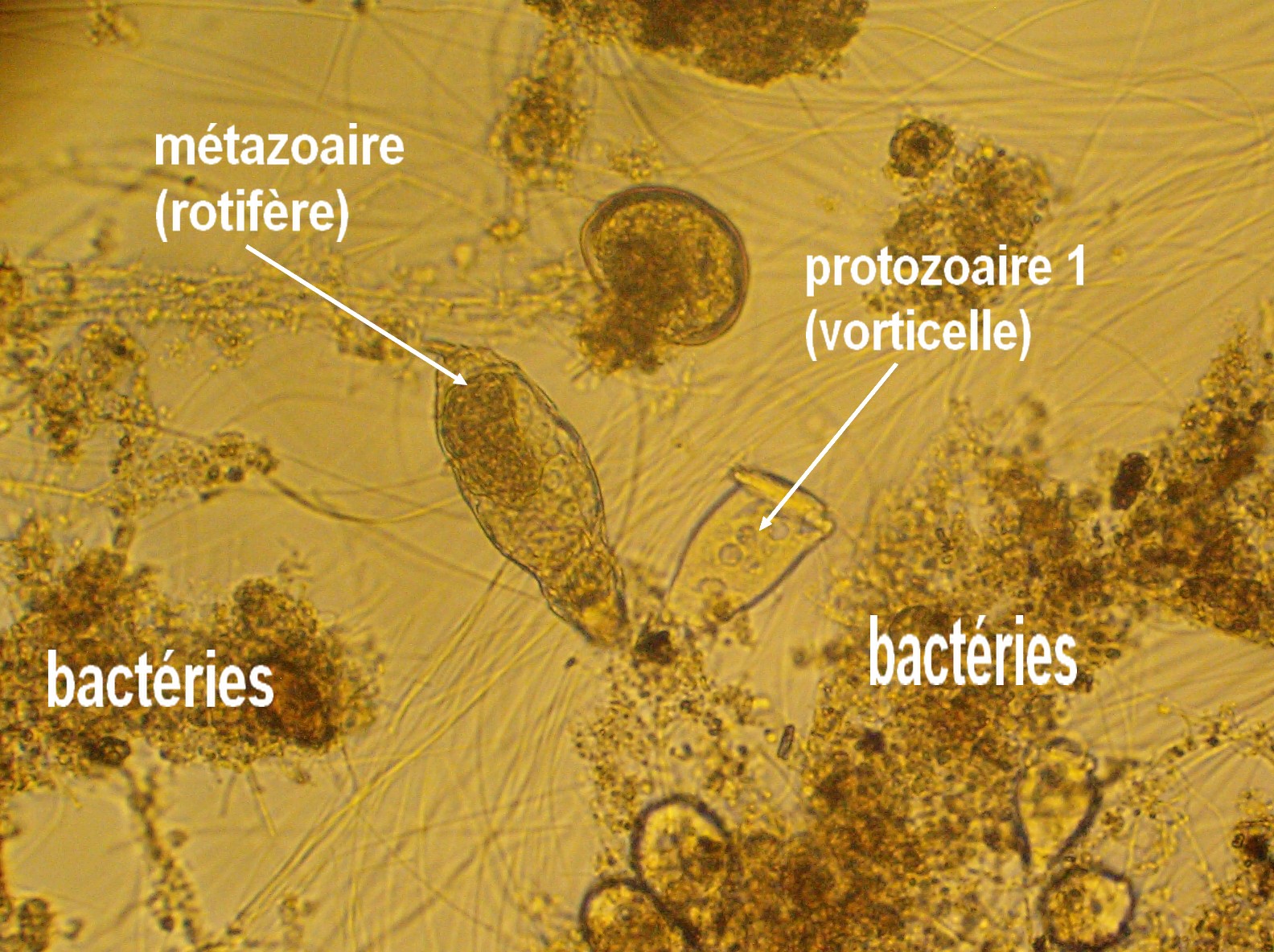
- Protozoaires à raison de 50 000/mL de boue activée. Ils se partagent en différentes classes comme les zooflagellés (Bodo…), les holotriches (Litonotus…), les hypotriches (Aspidisca…) et les péritriches (vorticelles…).
- Métazoaires comme les rotifères et les nématodes.
2.1.3.3. Fonctionnement de la boue activée
La boue activée est organisée comme une chaîne alimentaire, les bactéries étant à la place des producteurs et se multipliant de manière proportionnelle à la charge organique. Les autres organismes établissent des relations de prédation ou de compétition.
Les bactéries minéralisent la matière organique alors que les autres organismes favorisent leur élimination, participant ainsi au maintien d'une biomasse bactérienne constante et à la clarification du liquide interstitiel.
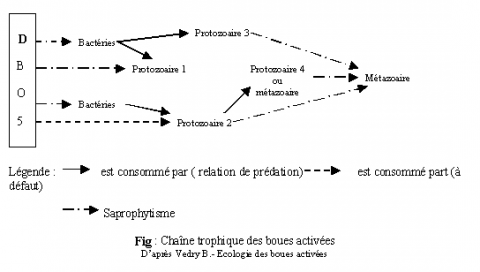
1/ production primaire constituée de bactéries et de zooflagellés (croissance proportionnelle à la DBO5).
2/ protozoaire 1 se nourrissent de bactéries et de matière organique. Leur croissance n'est pas proportionnelle à la pollution. Ils participent à la régulation du nombre de bactéries.
3/ protozoaire 2 se nourrissent préférentiellement de bactéries, si la nourriture vient à manquer peuvent pratiquer le saprophytisme.
4/ protozoaires 3 : compétiteur de protozoaire 2 car ayant les mêmes nourritures et les mêmes préférences. L'un peut se développer aux dépens de l'autre.
5/ protozoaire 4 ou métazoaire : prédateurs du protozoaire 2, tendent à le faire disparaître au profit de protozoaire 3.
6/ métazoaire : se nourrit de débris de protozoaires et dépolymérise la matière organique particulaire au profit des bactéries.
2.1.3.4. Processus biochimiques
Élimination de la matière organique
Minéralisation de la DBO5 apportée par l'effluent : oxydation directe de la DBO5

Cette étape de minéralisation de la matière organique (oxydation du glucose en CO2 et H2O) s'accompagne d'une assimilation d'une fraction de l'azote de Kjeldahl (à hauteur de 5 % de la valeur de la DBO5 assimilée) et d'une production de biomasse (C5H7NO2).
Minéralisation de la biomasse produite : oxydation indirecte de la DBO5

Cette seconde réaction n'a cours que dans certaines conditions, en particulier quand le teneur en DBO5 devient insuffisante par rapport à la biomasse présente. Il s'en suit une minéralisation complète de la biomasse formée.
Cette seconde réaction n'est jamais totale et son importance dépend de la charge organique appliquée dans le bassin d'aération. Plus la charge organique à éliminer par unité de masse de biomasse est faible, plus cette réaction sera importante et vis versa.
En traitement des eaux on définit cette phase par les termes de « respiration endogène » ou d'« autooxydation » de la biomasse.
2.1.3.5. Phase de décantation
Elle aura pour but de séparer la biomasse épuratrice et les MES de l'eau épurée : il y a production de boues biologiques. Les principes et contraintes de la phase de décantation sont identiques à ceux décrits dans le traitement physico-chimique, ainsi que pour le devenir des boues.
2.2. Par voie physico-chimique
2.2.1. Objectifs et principes
Il s'agit d'éliminer la pollution dissoute et particulaire par action de réactifs chimiques. Ces réactifs vont favoriser le passage de la forme dissoute des polluants à une forme particulaire insoluble dans l'eau ou à une forme gazeuse. Les matières polluantes devenues insolubles seront éliminées par décantation.
On aura ainsi deux phases :
- phase chimique : ajout des réactifs
- phase physique : séparation des solides de l'eau à traiter : phase de décantation
Dans le domaine de l'épuration, le traitement physico-chimique de la pollution est classé parmi les traitements secondaires, le traitement primaire correspondant à un processus unique de prédécantation des eaux usées.
2.2.2. Caractéristiques des matières polluantes à éliminer
Matières en suspension
- Matières d'origine organique (débris d'animaux et de végétaux) ou minérale (sables, limons…).
- Elles représentent la fraction décantable des MES, de la DCO, de la DBO5, de l'azote de Kjeldahl et du phosphore total.
- Taille de 1 µm à 1 mm et plus
- Ces matières sont naturellement décantables, donc peu visées par la phase chimique. Elles seront éliminées lors de la décantation.
Matières colloïdales
- Matières de mêmes origines que les matières en suspension.
- Elles représentent une fraction (fraction colloïdale) de la DCO, de la DBO5, de l'azote de Kjeldahl et du phosphore total non particulaire.
- Taille : 50 à 500 nm.
- La décantation naturelle de ces matières est extrêmement lente, puisqu'on estime qu'il leur faut de 2 à 200 ans (extrapolation) pour sédimenter dans une colonne de 1 mètre d'eau. Il faudra donc provoquer leur insolubilisation pour pouvoir les éliminer par décantation.
Le comportement de ces matières dissoutes vis à vis des réactifs chimiques couramment employés dans le traitement des eaux est très variable. En effet, les réactifs chimiques ont une action très infime sur les matières organiques, bien qu'on note une co-élimination avec les matières colloïdales. Par contre eux réagissent très bien avec certains minéraux, comme les phosphates par exemple.
Conclusion
Les traitements physico-chimiques des eaux usées seront essentiellement dirigés vers :
- une élimination " provoquée " des colloïdes et des ions phosphates
- une élimination naturelle des matières en suspension par décantation
2.2.3. Phase chimique : la coagulation
2.2.3.1. Élimination des colloïdes
Les colloïdes sont caractérisés par une grande stabilité lorsqu'ils sont dans l'eau, c'est à dire leur capacité à rester en suspension. Cette caractéristique est due à leur structure moléculaire.
Stabilité des colloïdes
Les particules hydrophiles déshydratées se dispersent spontanément dans l'eau et sont entourées de molécules d'eau qui préviennent tous contacts ultérieurs entre les particules. De plus elles possèdent habituellement des charges électriques négatives situées à leur surface. Ces charges, dites « primaires », attirent les cations en solution dans l'eau, lesquels adhèrent fortement à la particule et attirent à leur tour des ions négatifs accompagnés d'une faible quantité d'ions positifs, il y a formation d'une double couche.
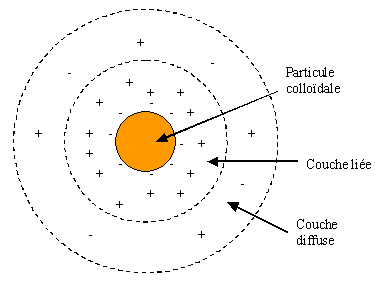
La couche liée est formée par des ions qui adhèrent fortement alors que la couche diffuse est formée par des ions qui adhèrent faiblement. Il y a un gradient électrostatique entre la surface de la particule et la solution empêchant les phénomènes d'agglomération entre colloïdes. Les forces en jeux peuvent être schématisées par le graphe suivant :
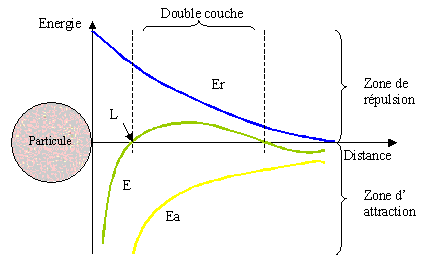
La courbe (E) schématisant le phénomène général de répulsion électrostatique est la résultante de la courbe de l'énergie d'attraction, (Ea) (interactions de Van der Waals) et de la courbe de l'énergie de répulsion (Er) (gradient électrostatique). Lorsque la distance qui sépare deux particules est supérieure à la distance critique L, les forces de répulsion l'emportent.
Pour favoriser les forces d'attraction (courbe Ea) il faut rompre la stabilité des colloïdes en comprimant la double couche.
Déstabilisation des colloïdes
Cette déstabilisation, ou coagulation, correspond à l'ajout d'un cation trivalent métallique, le coagulant, qui va faire augmenter la force ionique de l'eau, provoquant la compression de la double couche. L'énergie de répulsion (Er) sera neutralisée et les particules pourront alors s'agglomérer sous l'influence des interactions de Van der Waals (Ea). Le résultat de cette compression est présenté ci-dessous :
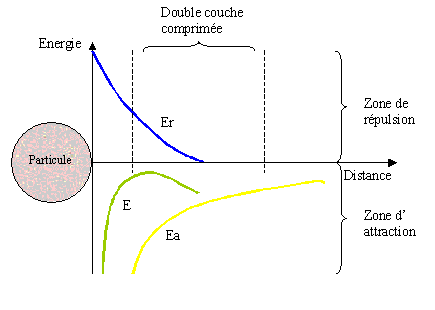
La coagulation correspond à deux phénomènes :
- adsorption et neutralisation des charges des colloïdes,
- emprisonnement des particules colloïdales dans un précipité : les cations trivalents métalliques (Me3+) utilisés ont la particularité de s'hydrolyser au contact de l'eau et forment un hydroxyde métallique insoluble lorsqu'ils sont à pH neutre.
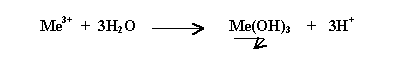
Coagulants utilisés
Sels d'aluminium
Le plus utilisé est le sulfate d'aluminium :
- présentation commerciale : poudre blanche à 18 molécules d'eau : Al2(SO4)3,18H2O
- nom commercial : sulfate d'alumine
- réactions au contact de l'eau :
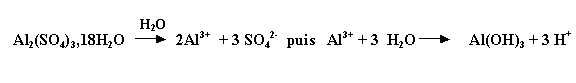
Cette réaction est optimale à pH compris entre 6 et 7,5 (prédominance de la forme Al(OH)3). les doses utilisées en traitement des eaux usées : 100 à 300 g/m3 en Al2(SO4)3,18H2O.
Sels de fer
Le plus utilisé est le chlorure ferrique (présentation commerciale : liquide brun) correspondant à une solution à 594,5 g/L en FeCl3.
La solution commerciale est présentée comme étant une solution de densité = 1,45 à 41 % de pureté en chlorure ferrique :
- nom commercial : chlorure ferrique
- réaction au contact de l'eau :
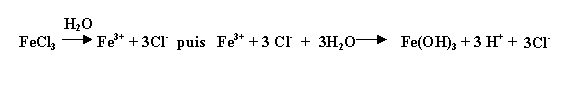
Cette réaction est optimale à pH compris entre 5 et 9 (prédominance de la forme Fe(OH)3).
Les doses utilisée en traitement des eaux usées : 50 à 250 g/m3 en FeCl3
2.2.3.2. Élimination du phosphore
Voir l'article correspondant (4. Élimination du phosphore)
2.2.3.3. Autres polluants
Les coagulants n'ont qu'une action très limitée sur l'azote de Kjeldahl et la fraction soluble de la DCO et de la DBO5. Cette dernière est le plus souvent indirecte et correspond à des phénomènes d'adsorption sur les particules déstabilisées ou sur les précipités.
Ce processus devra donc être complété si on veut éliminer la fraction dissoute de l'azote de Kjeldahl, de la DCO et de la DBO5 .
2.2.4. Phase physique : la floculation et la décantation
Il s'agit de favoriser l'agglomération des matières coagulées ou précipitées pour former un solide qui sera éliminé de l'eau par décantation.
2.2.4.1. Maturation du solide : la floculation
Cette phase préalable à la décantation consiste à favoriser l'agglomération des matières déstabilisées ou précipitées sous l'influence d'une agitation lente. On cherche à favoriser le contact entre les particules pour permettre leur agglomération, sans non plus briser les agglomérats que l'on appelle : Floc. Ce floc est assez fragile puisque les interactions qui le maintiennent sont des interactions de Van der Waals.
Cette phase peut être optimisée par l'ajout d'un adjuvant de floculation : le floculant. C'est une molécule organique, cationique et polymérique qui va favoriser les pontages entre les particules déstabilisées.
2.2.4.2. Décantation
Les particules en suspension, dont la densité est supérieure à celle de l'eau, sédimentent sous l'influence de leur propre poids et s'accumulent au fond de l'ouvrage. L'eau décantée est collectée en surface. Le moteur de cette séparation est donc la gravité.
On distingue deux types de décantation :
- décantation des particules grenues
- décantation des particules floculantes
Décantation des particules grenues
Ce type de décantation est caractérisé par le fait que les particules conservent leurs propriétés physiques initiales : forme, dimension et densité.
La vitesse de chute de la particule est indépendante de la concentration en solides, et augmente jusqu'à ce que la force de décantation (poids) s'équilibre avec les forces de frottement : la vitesse de sédimentation est donc constante. On peut alors schématiser cette décantation comme suit :
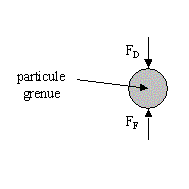
Fd = force de décantation due à la pesanteur (dépend de la densité de la particule)
Ff = force de frottement = résistance de l'eau (dépend de sa viscosité)
Décantation des particules floculantes
Durant la décantation, les particules s'agglomèrent à un certain rythme formant ainsi des particules de dimension et de densité qui augmentent. La vitesse de chute de la particule varie au cours de la décantation et ne dépend que de la concentration locale en particules (hypothèse de Kynch). Ces phénomènes sont représentés par la courbe de Kynch : évolution de la vitesse de sédimentation en fonction du temps.
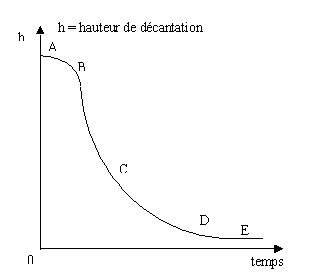
AB = phase de coalescence : séparation particules /eau plus ou moins nette
BC = augmentation constante de la vitesse de chute de la particule en fonction du temps
CD = ralentissement progressif de la vitesse de chute de la particule : les particules se gênent
DE = décantation fortement freinée : décantation en flux piston
2.2.4.3. Procédé de décantation
Dans un procédé industriel, comme dans une station d'épuration, la phase de décantation a lieu en continu. Les ouvrages sont alimentés par un flux d'eau constant qui entre et qui sort de l'ouvrage tout en permettant la décantation des solides.
Bases de fonctionnement des décanteurs
Pour que la décantation des solides puisse se faire correctement, il faut que la vitesse de l'eau soit inférieure à la vitesse de sédimentation des particules. Cette vitesse de l'eau est appelée charge hydraulique superficielle ou vitesse de Hazen (VH) et sert au dimensionnement des décanteurs.
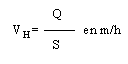
Q = débit d'eau à l'entrée du décanteur en m3/h
S = surface du décanteur en m²
Conditions de capture des particules
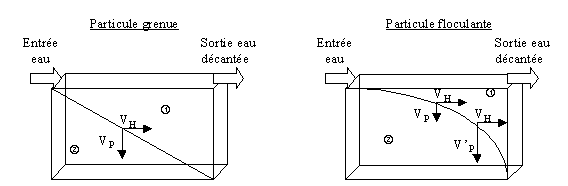
Pour les deux types de particules, les conditions de capture sont identiques :
1/ Lorsque la vitesse de sédimentation de la particule (VP) est inférieure à la vitesse de Hazen (VH), les particules ne sont pas capturées et partent avec l'eau traitée.
2/ Lorsque la vitesse de sédimentation des particules (VP) est supérieure à la vitesse de Hazen (VH), les particules sont capturées par le décanteur et s'accumulent au fond de l'ouvrage.
Dans le cas de la décantation d'une particule grenue, la droite transversale représente la vitesse minimale que la particule doit avoir pour être capturée.
Dans le cas de la décantation d'une particule floculante, la courbe transversale traduit le fait que la vitesse de la particule augmente au cours de la décantation (VP < V'P). Le temps de séjour est, pour ces particules, le facteur limitant.
Enfin, particules grenues (matières en suspension de l'eau usée) et particules floculantes (flocs de colloïdes coagulés et précipités de phosphates) pourront être retenues dans le même ouvrage en imposant une vitesse de Hazen qui permettra la capture de chacune de ces particules.
2.2.5. Bilan
2.2.5.1. Détermination de la dose optimale de réactif
Quelle que soit la matière à coaguler ou à précipiter, la détermination de la dose optimale de coagulant/floculant se fait au laboratoire grâce à un Jar-test :
- introduction de quantités croissantes de coagulant dans des jarres (6) contenant un litre d'eau à traiter et munie d'une hélice d'agitation
- agitation rapide (150 rpm) pendant 3 minutes : phase de coagulation
- introduction éventuelle du floculant
- agitation lente (40 rpm) pendant 10 minutes : phase de floculation
- arrêt de l'agitation et attente de 20 minutes : phase de décantation
- analyse des différents paramètres de la pollution sur le surnageant et détermination des rendements d'élimination de la pollution
- On choisit la jarre qui présente les meilleurs rendements, la dose optimale de coagulant, appelée taux de traitement, correspondant à la quantité de coagulant injecté pour un litre d'eau usée de la jarre sélectionnée. Le taux de traitement s'exprime en mg de coagulant /L d'eau usée (ou en g/m3).

Exemple de résultat d'un jar-test
1) avant introduction des réactifs : trouble colloïdal

2) pendant la phase de floculation

3) après la phase de décantation

2.2.5.2. Filière de traitement
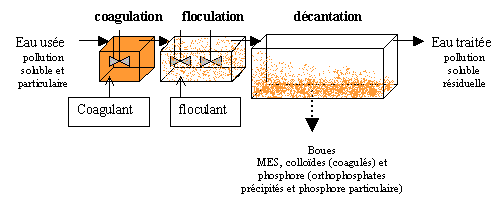
2.3. Paramètres de conduite des stations à boues activées

Retour au sommaire
3. Élimination de l'azote
L'élimination de l'azote par voie biologique requiert des bactéries aux types trophiques très différents, les différentes formes de l'azote servant tour à tour de source d'azote, de source d'énergie et d'accepteur final d'électrons et de protons. Le processus peut être schématisé ainsi :
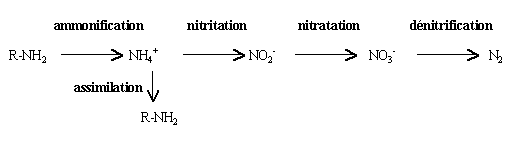
Minéralisation de l'azote inorganique : ammonification

Cette réaction, réalisée par des germes hétérotrophes, ne permet pas de fournir un abattement en azote de Kjeldahl important mais simplement de fournir une source d'azote minéral pour que les bactéries puissent minéraliser et assimiler la pollution carbonée (Cf. réaction de minéralisation de la DBO5 ). L'azote minéral est transféré de la phase liquide vers la phase solide (biomasse) par assimilation et sera éliminée en fin de filière.
Les stations d'épuration soumises à des contraintes sévères en termes de rejets azotés (zones sensibles à l'eutrophisation) doivent compléter ce traitement par un traitement qui permettra de transformer l'ammonium en diazote : réactions de nitrification - dénitrification.
Oxydation de l'ammonium : nitrification
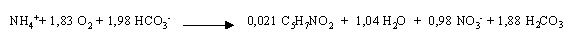
Cette réaction globale, liée aux synthèses cellulaires, rend compte de l'action de deux groupes de germes chimiolithoautotrophes sur l'ammonium : les germes nitrifiants. Ces germes, dont l'un est nitritant (Nitrosomonas) et l'autre nitratant (Nitrobacter), sont aérobies strictes et tirent leur énergie de l'oxydation de l'ammonium.
Cette réaction n'est possible en station d'épuration que si la DBO5 est suffisamment minéralisée et si les conditions d'oxygénation suffisantes :
- la quantité de CO2 (source de carbone) issue de la minéralisation de la DBO5 doit être suffisante pour permettre le développement des autotrophes nitrifiants.
- la quantité de DBO5 (source de carbone et d'énergie des hétérotrophes) doit être suffisamment faible pour que les nitrifiants ne soient pas en compétition avec les germes hétérotrophes pour l'ammonium (source d'azote et d'énergie). Le temps de génération des hétérotrophes étant de 30 minutes à 1 heure, contre 24 heures pour les nitrifiants, ceux-ci peuvent représenter l'espèce dominante et séquestrer l'ammonium et l'oxygène aux dépens des nitrifiants.
- teneur en oxygène libre supérieure ou égale à 2 mg/L.
Réduction des nitrates : dénitrification dissimilatrice
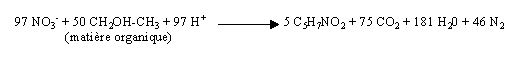
Cette réaction, liée aux synthèses cellulaires, est catalysée par des bactéries chimioorganotrophes aérobies strictes pratiquant la respiration anaérobie. Les nitrates, issus de la nitrification, servent d'accepteurs finaux d'électrons et de protons dans le processus de respiration. A l'inverse de la précédente, cette réaction n'est possible que dans les conditions suivantes :
- la teneur en DBO5 doit être suffisante pour permettre le développement des hétérotrophes dénitrifiants.
- on doit être dans des conditions d'anoxie, c'est à dire présence d'oxygène lié (NO3-) et absence d'oxygène libre (O2) afin de favoriser la respiration sur nitrates.
L'anoxie est mesurée par le potentiel redox du milieu et correspond à une valeur moyenne de EH2 = +150 mV.
Remarque : pour l'aérobiose, hormis la mesure de l'oxygène dissous, elle correspond à une mesure de potentiel redox de l'ordre de EH2 = +350 mV.
On arrive dans des conditions d'anaérobiose (absence d'oxygène libre et d'oxygène lié) lorsque EH2 = 0 mV.
Cette élimination conjointe de l'azote est très difficile à mettre en œuvre dans une filière classique et nécessite la conception de deux bassins séparés dans lesquels sont générées les conditions optimales de chacun.
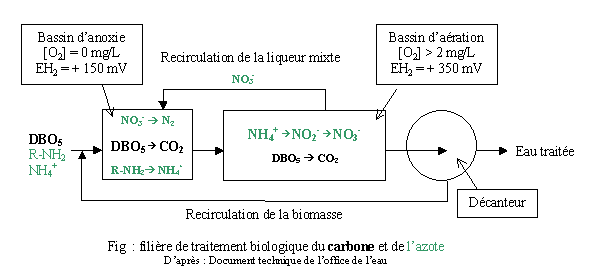
Le bassin d'anoxie doit être plus petit que le bassin d'aération, cette différence de taille permettant de générer, dans le bassin d'anoxie, les conditions idéales de développement des hétérotrophes et dans le bassin d'aération les conditions idéales de développement des autotrophes. Les germes dénitrifiants génèrent, par la respiration nitrate, le CO2 nécessaire aux nitrifiants et ont besoin d'un apport suffisant en carbone organique, d'où le positionnement de la zone d'anoxie en tête de filière.
Retour au sommaire
4. Élimination du phosphore
4.1. Par voie biologique
Elle repose sur la génération de deux phases :
1/ Phase anaérobie : des germes aérobies stricts qui, sous l'action du stress anaérobie, libèrent du phosphore dans le milieu et accumulent des réserves de polyhydroxybutyrate.
2/ Phase aérobie : les mêmes germes aérobies strict réabsorbent le phosphore libéré plus celui présent dans l'eau usée en hydrolysant leur réserve de polyhydroxybutyrate : on parle d'assimilation pléthorique.
Globalement, il y a eu plus de phosphore absorbé que de phosphore libéré, le phosphore de l'eau usée ayant été transféré de la phase liquide vers la phase solide. Il sera donc éliminé dans les boues lors de la phase de décantation.
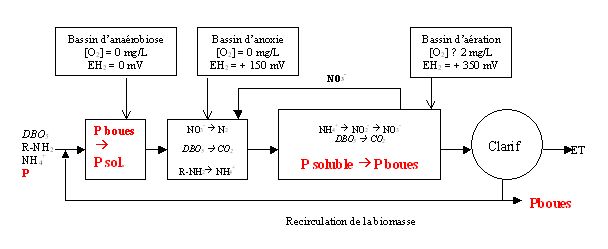
4.2. Par voie physico-chimique
Le phosphore soluble des orthophosphates et des polyphosphates est éliminé par précipitation avec le coagulant. Le phosphore particulaire sera éliminé lors de l'étape de décantation avec les autres matières en suspension.
Réactions :
À pH neutre, la forme hydrogénophosphate prédomine :
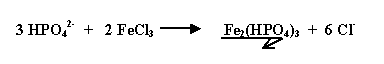
Dans la pratique on constate que la dose réelle de chlorure ferrique ne correspond pas à la stœchiométrie de la réaction mais qu'il faut un excès de réactif. La dose optimale sera donc déterminée au laboratoire grâce au jar-test.
La littérature propose comme base de détermination de la dose optimale de coagulant un rapport molaire Fe/P = 2.
- chlorure ferrique(FeCl3) en solution commerciale (d =1,45 - 41 % de pureté)
- chlorosulfate ferrique (FeClSO4) en poudre, autrement appelé Clairtan.
Le précipité ainsi formé est éliminé par décantation
Retour au sommaire
